
癌癥的早期篩查是必要的,因為大多數腫瘤只有當它們含有數百萬可能已經轉移的細胞、達到一定的大小時才能被檢測到。目前采用的診斷技術,如醫學成像、組織活檢和酶聯免疫吸附試驗(ELISA)對體液的生物分析所具有的敏感性和特異性不足以檢測大多數類型的早期癌癥。此外,這些分析是勞動密集型、耗時、昂貴的,且沒有能夠反復利用結果的能力。另一方面,基于量子點的檢測是快速、簡單和經濟的,可以實現癌癥標志物的快速護理點篩查。量子點具有獨特的特性,使其成為檢測腫瘤的理想選擇,包括長時間的強而穩定的熒光、耐光漂白性[1-5]、大的摩爾消光系數、高靈敏度的檢測,因為它們具備在吸收和發射光上均非常高效的能力。由于量子點具有較大的表面積體積比,單個量子點可以與多種分子結合,因此量子點在設計更復雜的多功能納米結構方面具有很大的應用價值。各種類型的生物標記物,如蛋白質,特定的DNA或mRNA序列和循環腫瘤細胞,已經可以從血清樣本中確定用于癌癥診斷。因此,基于量子點(QD)的多路復用方法[1]可以同時識別多個生物標志物,從而可以實現更有效的癌癥診斷。量子點已被共價連接到各種生物分子,如抗體、多肽、核酸和其他配體,用于熒光探測[6-19]。其在生物學中的一些應用[20-32]以及它們在體內分子成像方面的巨大潛力[33-37]正在一一被揭開。
無機量子點相對于有機熒光團的優勢
與生物實驗中用于熒光標記的傳統有機熒光團相比,無機量子點由于其對光漂白的高抗性,使生物材料的可視化時間更長,應用范圍更廣。由于熒光團對周圍環境非常敏感,可以進行光漂白,這是一種不可逆的光氧化過程,使它們成為非熒光體,是所有需要長時間觀察熒光團標記結構的研究的主要限制。熒光團只能在很窄的波長范圍內被光學激發,熒光發射也被限制在一定的波長范圍內。而量子點可以用波長比熒光波長短的單一光源激發。量子點的熒光光譜較窄、對稱,在熒光團中沒有紅尾,各種顏色都可以被觀察和區分,沒有任何光譜重疊。因此,用不同顏色的量子點對不同結構進行多色標記成為可能。這種多路復用的方法[3, 38-40]在疾病診斷和藥物輸送等場景中具有廣闊的應用前景。
量子點是一個跨學科的研究領域,經過化學、物理、生物和醫學等不同學科的人員共同努力,有利于發現它的最大價值,將它們用于癌癥的檢測和治療就是一種極為重要的應用。
量子點技術
量子點是一種具有獨特發光特性的無機半導體納米晶體,其典型直徑在2-8nm之間。它們通常由元素周期表中的II和VI族元素(例如CdSe和CdTe)或III和V族元素(例如InP和InAs)的原子組成。它們的物理尺寸小于導致量子限制效應的波爾半徑[1]激子,這就是它們具有獨特的光學和電子特性的原因。
量子點的合成
高質量的量子點已經可以通過各種方法合成[41-43],但通常它們的合成是在有機溶劑中進行的,如甲苯或氯仿,并且會添加表面活性劑,反應溫度較高。但表面活性劑包覆的顆粒不溶于水,其極性表面活性劑頭基會附著在量子點(QD)的無機核心上,疏水鏈則會凸出到有機溶劑中,而一般來說,所有細胞實驗都涉及水溶性物質。因此,為了使表面活性劑具有水溶性,人們制定了各種策略,要么替換表面活性劑層,要么涂上額外的保護層,如親水或兩親聚合物[44-45]。表面活性劑的疏水涂層被配體分子所取代,配體分子一端攜帶官能團與量子點表面結合,另一端攜帶親水性基團使量子點可溶于水。也有報道使用兩親性聚合物作為QD表面的附加涂層[38, 46-48]。聚合物的疏水尾部與QD表面的疏水表面活性劑層發生反應,而聚合物的親水基團在外端產生水溶性。量子點還被包裹在磷脂膠束[8]中,使其可溶于水。
量子點的性質及應用
最常用的量子點系統是CdSe的內半導體核包覆ZnS的外殼。ZnS殼層負責保障CdSe核的化學和光學穩定性。只需改變量子點的大小,就可以使其發出從紫外線到紅外光譜中所有波長的熒光。量子點的熒光波長取決于它的能隙(即激發態和基態之間的差),這是由量子點的大小決定的[49-52]。量子點具有光譜線寬窄、亮度高、寬光譜范圍內吸收系數大、高光穩定性和多路探測能力等特點,即使在復雜的體內條件下,它們也非常明亮和穩定,這使它們適用于先進的分子和細胞成像、藥物傳遞以及高靈敏度的生物測定和診斷的應用[53-54],QD生物偶聯物使具有更高分辨率的高靈敏度實時成像,和對活細胞表面單個受體分子的跟蹤成為可能[13,55]。量子點的各種應用如圖1所示。在大多數情況下,用于癌癥檢測的功能QD共軛物由半導體核心(CdSe, CdTe)組成;在CdSe作為量子點的情況下,會增加一個額外的殼層,如ZnS,因其具有比CdSe更高的能帶隙,能夠提高量子產率,同時可作為水溶親水性涂層,以及作為功能化抗體或其他生物分子在腫瘤位點的補充靶向癌癥標記物。
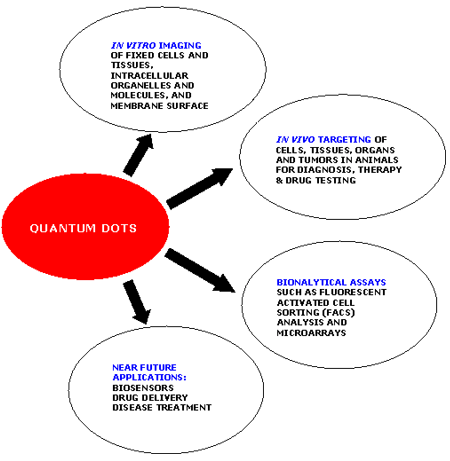
圖1. 量子點的應用
克服量子點的毒害性
由半導體納米粒子組成的天然量子點在自然界中是有毒的。已經觀察到,CdSe量子點對暴露在紫外線下較長時間的細胞有很高的毒性,因為紫外線會溶解CdSe,從而釋放出有毒的鎘離子。然而,在體內研究[48]表明,聚合物涂層量子點在沒有紫外線的情況下是無毒的。研究還表明,將膠束包裹的量子點注射到青蛙胚胎中并不影響其發育[8]。因此,量子點通常被封裝在兩親性聚合物的外殼涂層內[57-58],使其具有水溶性,并能抵抗化學或酶降解。它們通常在有機溶劑中合成,如三-正辛基-氧化磷化氫(TOPO)[59-62]和十六烷基胺,它們具有長烷基鏈和高沸點,從而可以防止形成聚集體。近年來,對量子點進行表面化學修飾使其具有水溶性的研究取得了很大的進展[63-64]。最為常見的是,量子點與聚乙二醇(PEG)或類似的配體連接,以使它們具有生物相容性并減少非特異性結合。通過使用不同的策略將它們與各種生物親和配體(如多肽、抗體、寡核苷酸等)結合,使它們對目標位點具有特異性。用于檢測腫瘤細胞生物標記物的QD生物偶聯物的可能示意圖如圖2所示。圖3則簡要描述了QD技術用于癌癥體內診斷的各個步驟。
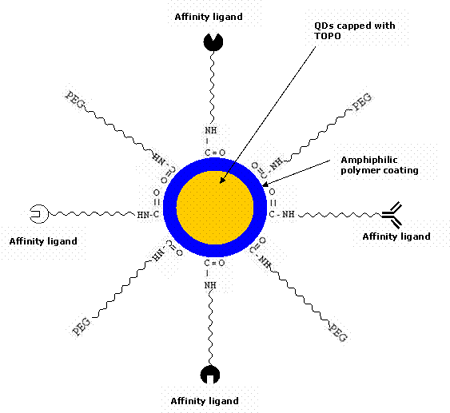
圖2. 多功能量子點通常用于靶向腫瘤細胞。QDs與各種親和配體(肽、抗體、抑制劑、藥物等)結合,這些配體對腫瘤細胞的生物標志物具有特異性。
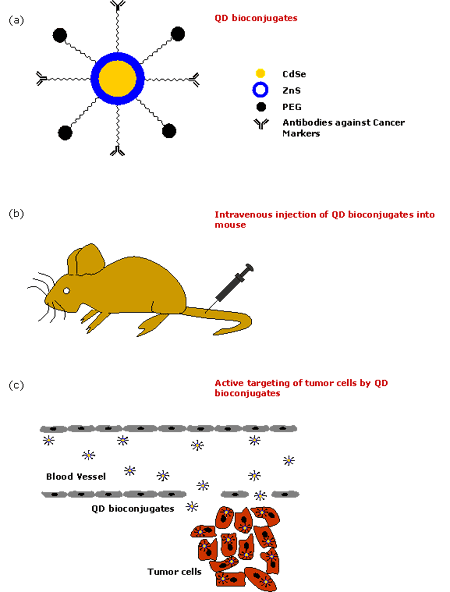
圖3. 量子點用于癌癥體內診斷的步驟。(a)QD生物偶聯物的形成,(b)將QD生物偶聯物靜脈注射到小鼠體內,(c)QD生物偶聯物能有效靶向腫瘤細胞。
量子點的閃爍行為
Nirmal等人[65]首次發現,量子點在連續激發下會表現出閃爍行為,即間歇性開關發射,這歸因于俄歇電離[65-66]。即使在今天,這種行為的原理也沒有得到很好的解釋。但是,只有在分析過程中需要單個QD的信號時(如流式細胞術應用程序),它才需要被重點關注到。在這種情況下,單個量子點的發射可能由于“閃爍”而關閉,從而導致探測器的信號丟失。但通常在大多數應用中,如在基于細胞的分析中,涉及多個量子點,即使一些量子點閃爍,其他量子點也會發出信號供最終檢測,因此,檢測器不會遺漏任何信號。一種抵消閃爍導致的量子產率降低的方法是在量子點核心的頂部組裝一個由幾層具有更大能帶隙的材料原子層組成的殼層。
表面功能化對量子點光學性質的影響
一些基礎研究表明,量子點的發光對表面功能化過程非常敏感,因為分子與量子點表面的相互作用會改變量子點表面的電荷[67],但許多基于量子點的探測應用是基于目標分析物分子與量子點表面功能化的生物分子相互作用后量子點熒光的變化而衍生的。量子點的表面功能化改善了其溶解度,但它也會降低量子效率。這在經巰基乙酸處理的量子點中得到了證明,量子效率大大降低[7, 63],但是蛋白質功能化的量子點傾向于保持它們的量子效率,并提供更長的保質期,它們還可以在不降低量子效率的情況下被多個官能團[7]進一步功能化。
用于觀察和追蹤量子點的測量系統
使用共聚焦顯微鏡、全內反射顯微鏡或外熒光顯微鏡可以對單個量子點進行更長時間的觀測和追蹤,最長可達數小時。Gao等人[68]和So等人[69]介紹了利用量子點作為標簽進行熒光成像及其測量的方案:Gao等人采用了波長分辨光譜成像的全身宏觀照明系統,可對體內分子靶標進行高靈敏度檢測;So等人也采用了波長分辨光譜成像系統,其軟件可將自發熒光與量子點信號分離。
主動和被動量子點靶向技術
QD生物偶聯物可以通過主動靶向和被動靶向兩種機制在體內傳遞給腫瘤,盡管被動靶向比主動靶向慢得多,效率也低得多。在被動靶向機制中,由于增強的通透性和保留作用,QD生物偶聯物優先聚集在腫瘤部位[70-72]。這種效應可以歸因于血管生成腫瘤(i)產生血管內皮生長因子,負責增強滲透性,(ii)缺乏有效的淋巴引流系統,這導致QD生物偶聯物積累。另一方面,在主動靶向機制中,抗體偶聯QD將抗體與腫瘤細胞上存在的前列腺特異性膜抗原等特異性腫瘤生物標記物結合在靶向部位。
深層組織成像要求
研究表明,深層組織成像需要使用遠紅外線和近紅外線[73],這就需要使用近紅外發光的QD來提高腫瘤成像的靈敏度,因為血液和水[74]的主要吸收峰在這一區域不會產生干擾。
去除活細胞中的量子點
在將該技術用于人類的癌癥診斷和治療之前,需要對QD從活體動物體內的清除及其新陳代謝進行更加重點的關注和深入研究,受保護的QD從體內清除的唯一途徑是通過腎臟緩慢過濾和排泄,因為通過化學或酶分解的可能性很小。
量子點在疾病診斷和治療中的潛在應用
基于量子點技術的最新進展和研究人員對此的濃厚興趣,在不久的將來,量子點在疾病診斷和治療領域將會有諸多潛在的應用。
生物分子與量子點的結合
目前已開發出各種共價和非共價策略(如圖4所示),用于將蛋白質和抗體等生物大分子與量子點結合。生物大分子可以利用交聯劑[1, 6, 8, 17, 38, 44, 64, 75-77]進行共價結合,交聯劑將量子點表面的-COOH、-NH2或 -SH等官能團與生物大分子上的官能團交聯。如今,有各種共軛化學方法可用于修飾生物大分子,使其具有所需的官能團。
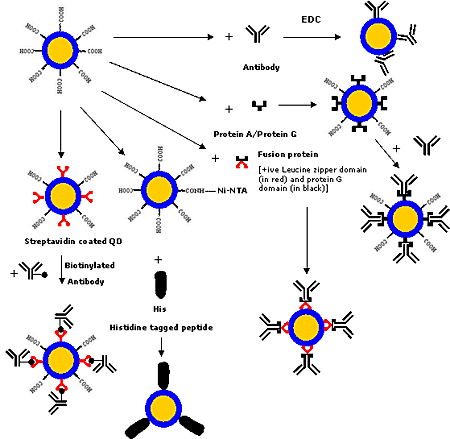
圖4. 將抗體/蛋白質與量子點連接的各種策略
修飾生物分子的策略
其中一種策略采用N-乙基-N′-(3-二乙基氨基丙基)碳二亞胺(EDC)作為雜交連接劑,將量子點的羧基與蛋白質的氨基交聯。這種方法不需要對蛋白質進行任何化學修飾,因為大多數蛋白質都含有伯胺。
另一種策略是基于活性酯馬來酰亞胺介導的胺和巰基偶聯。但這種方法有一個局限性,即游離的巰基在氧氣存在下不穩定,在原生生物大分子中很少發現。最近,Pellegrino等人[46]采用了含有多個酸酐單元的預活化兩親聚合物將蛋白質與量子點結合。由于聚酐是可生物降解的聚合物,因此這種方法有可能應用于制造持續給藥系統,但將生物大分子與量子點精確控制和定向結合的策略尚未被深入研究。Goldman等人[78]利用一種融合蛋白將免疫球蛋白G(IgG)與量子點結合,該融合蛋白具有一個帶正電的亮氨酸拉鏈結構域,可與帶負電的量子點發生靜電結合,而蛋白G結構域可與IgG的恒定Fc區域結合,從而使F(ab′)2區域可自由用于抗原結合。鎳-氮三乙酸(Ni-NTA)作為螯合劑,可用于將六組氨酸標記的生物大分子與量子點結合。Gao和他在美國埃默里大學的研究小組正在開發這種技術,它在生物分子的可控定向結合、探針體積小和生產成本低等方面具有優勢。鏈霉親和素-生物素結合策略也可用于將生物大分子與量子點結合,因為鏈霉親和素涂層的量子點可在市場上買到,而且很容易與生物素化的生物大分子結合[13, 38, 55, 59, 80]。圖4展示了量子點的各種生物共軛策略。
量子點對生物分子生物學功能的影響
研究表明,在許多情況下,生物大分子與量子點的共軛不會改變生物大分子與其特定受體的結合能力[6, 8-9, 13, 17, 38, 55, 58-59 64, 76-77, 80-81]及其生物功能。Kloepfer等人[77]發現,將量子點與轉鐵蛋白共軛不會影響蛋白質的功能。Dahan等人[82] 也觀察到,量子點與膜結合受體的結合對受體在膜中的擴散行為沒有影響。不過,也有少數報道稱量子點可能會影響生物大分子的生物功能,如神經遞質血清素與血清素轉運蛋白的結合親和力[14]。這可能是由于量子點的立體阻礙作用,要確認量子點對生物大分子的生物功能可能產生的影響,還需要進行詳細的研究。
量子點技術在癌癥診斷中的應用進展
在早期階段,量子點被用于幾種成像應用,以取代有機染料,但當觀察到這些材料持續發射強熒光數周后,這些材料的巨大應用潛力才得以實現。這是顯微成像技術的重大進步,有助于揭示許多細胞過程。在隨后的發展階段,研究人員對量子點技術產生了濃厚的興趣,并開始探索其在不同領域的應用。制備了由相同材料組成但尺寸不同的量子點,其經單一波長的光激活后可以產生不同的顏色。實驗證明,標記有生物分子(如抗體、多肽等)的量子點可用于檢測細胞表面或細胞內部的特定分子。
量子點-多肽偶聯物可靶向腫瘤細胞
Akerman和同事[58]發表了使用量子點-多肽偶聯物在體內靶向腫瘤血管的研究。他們采用了ZnS封裝的CdSe量子點,并展示了涂覆有不同多肽的量子點的靶向能力。通過靜脈注射后,涂有肺靶向肽的量子點在小鼠肺部聚集,該多肽與肺血管內皮細胞上的膜二肽酶結合;第二種情況是,涂覆有靶向肽的量子點與某些腫瘤的血管和腫瘤細胞結合;第三種情況,涂有靶向肽的量子點會與淋巴管和腫瘤細胞結合。該研究小組還表明,在量子點外涂層中添加PEG可防止其在網狀內皮組織中的非選擇性聚集。
量子點識別活體乳腺癌細胞的能力
量子點公司(Quantum Dot Corporation)和基因泰克公司(Genentech)的研究小組證明了量子點在識別可能對抗癌藥物產生反應的活體乳腺癌細胞方面的潛力[38]。他們采用與免疫球蛋白G(IgG)和鏈霉親和素相連的量子點來標記活體乳腺癌細胞表面的Her2癌癥標記物,并探索了同時標記細胞表面和細胞核中 Her2的量子點技術。研究人員用單一激發波長同時檢測了兩個細胞靶標,從而表明不同顏色的量子點(即尺寸不同但材料相同的量子點)可用于區分單個細胞的不同部分,從而實現多重靶標檢測。
多功能量子點同時靶向和成像活體動物的腫瘤
Gao和同事報道了多功能量子點同時靶向和成像活體動物的腫瘤的研究[68]。高度穩定的量子點共軛物由兩親性三嵌段共聚物(用于體內保護)、靶向配體(用于腫瘤抗原識別)和多個PEG分子(用于改善生物相容性和循環)組成。通過組織切片顯微鏡和全動物光譜成像監測量子點探針的體內行為,QD結合物通過靜脈注射小鼠,我們觀察到它們會通過被動靶向機制(由于腫瘤血管的滲漏)和主動靶向機制(由于包被腫瘤特異性抗體的QD偶聯物與腫瘤標記物相互作用)在靶向腫瘤部位聚集。Gao和同事還使用量子點標記培養中的特定細胞,觀察到在很短的一段時間內,量子點在細胞核中積累。因此,具有量子點的細胞在注射后,可以借助其熒光在活體動物體內進行跟蹤。
近紅外量子點用于前哨淋巴結繪圖
Kim和團隊[34]探索了利用發射波長為850 nm的近紅外量子點進行前哨淋巴結繪圖的實用性,這是在最靠近受影響器官的淋巴結中檢測游離癌細胞的主要途徑。將量子點經皮內注射到活體小鼠體內后,甚至在皮膚下1厘米處的前哨淋巴結也能得到實時跟蹤。這一進展是一項重大突破,因為在不使用放射性標記的情況下,切除前哨淋巴結所需的切口面積減小了。研究人員正在嘗試使用量子點技術來治療癌癥,一種可能性是用X射線/紅外光照射注射后的量子點,這將為腫瘤提供熱能并引發細胞凋亡/程序性細胞死亡的過程。
用于多路復用的量子點
Goldman和同事[83]在使用單一激發光源的夾心免疫測定中使用了四種具有不同發射波長的量子點,證明了量子點對四種毒素進行多重分析的能力。同樣地,Makrides和同事[84]在蛋白質印跡檢測中使用了兩種光譜不同的量子點來檢測兩種蛋白質。在需要檢測的目標腫瘤部位存在的各種癌癥生物標記物時,多路復用的方法具有極其重要的意義。
用于體內成像的自發光量子點
最近,斯坦福大學的Jianghong Rao研究小組證明,自發光QD共軛物(QD-Luc8)具有體內成像的潛在應用價值[69]。該研究小組開發了一種雷尼拉腎形熒光素酶(Luc8)的八次突變變體,它在血清中更穩定,催化效率更高。利用 1-乙基-3-(3-二甲基氨基丙基)鹽酸碳二亞胺(EDC)交聯劑,將Luc8與聚合物包覆的鎘/鋅核殼QD 655共軛,制成自發光 QD共軛,它們在沒有外部激發的情況下通過生物發光共振能量轉移(BRET)發光。BRET是一個能量從發光供體蛋白(如R. reniformis 熒光素酶)向附近的受體熒光蛋白進行非輻射性轉移的過程[69, 85-87],與現有的QD相比,它大大提高了小動物成像的靈敏度。用于體內成像的QD的最大優勢之一是,通過調整其尺寸,可在整個近紅外光譜范圍內調整其發射波長,從而產生在生物緩沖液中高度穩定的光穩定性熒光團。這是因為深層組織光學成像在近紅外光譜中效果最佳,因為瑞利散射隨波長增加而減少,而且動物體內的主要發色團(即血紅蛋白和水)在該光譜中具有局部吸收最小值。使用EDC將檢測癌癥生物標志物的抗體與QD-Luc8復合物結合。將形成的QD-Luc8抗體復合物通過尾靜脈注射到患癌小鼠體內,以檢測癌癥生物標志物。然后將小鼠麻醉并轉移到光密室中。幾分鐘后,靜脈注射Luc8的底物——腔腸素,并拍攝體內生物發光圖像。
基于量子點的靶向癌癥藥物傳遞系統
Shuming Nie及其同事[35]用一層防水的聚合物涂層改造了原始的鎘硒QD,防止了劇毒鎘離子從QD共軛物中滲出,并提供了一種將腫瘤靶向分子和給藥功能化學附著到QD共軛物上的方法,該研究小組正在開發一種針對癌細胞的給藥系統。開發的與肽或抗體結合的 量子點,用于靶向在小鼠體內生長的人類腫瘤細胞,QD將被調整為在紅外區域輻射,以防止能量發射對組織造成損害。與針對目標癌細胞表面癌癥標志物的特異性肽/抗體結合的量子點只有在受到激光照射時才會釋放藥物,這樣就可以控制接受毒素的細胞,從而將副作用降到最低。同時他們還在努力將量子點的熒光波長擴展到900 nm以上,因為幾乎沒有任何生物分子的熒光波長超過這一數值。
該技術的現狀
如今,在量子點技術的幫助下,癌癥研究人員能夠觀察到腫瘤細胞中發生的基本分子事件。這是通過熒光顯微鏡在體內跟蹤不同大小、不同顏色的QD(標記有多種不同的生物分子)來實現的,量子點技術在納米生物技術和醫療診斷等領域具有巨大的應用潛力,可被用作標簽。但要在人體中使用它們,仍需要進行廣泛的研究,以確定使用的長期影響。
量子點在癌癥診斷和治療中的應用前景
研究人員對量子點的探索始于最近二十年。雖然這一領域仍處于起步階段,但由于其獨特的光學和電子特性,它已深深吸引了科學家和工程師的關注。量子點已經徹底改變了分子成像領域,在未來幾年,它們將在不同領域得到不同程度的發展,影響最大的領域之一肯定是活細胞的細胞內成像,這項技術將為了解癌癥的病理生理學以及腫瘤成像和篩查提供新的見解。量子點在未來肯定會成為所設想的多功能納米設備的組成部分之一,這種設備可以檢測病變組織、提供治療并實時報告進展情況。
參考文獻
1. Chan W.C.W., Maxwell D.J., Gao X., Bailey R.E., Han M. and Nie S., “Luminescent QDs for multiplexed biological detection and imaging”, Curr. Opin. Biotechnol., 13, 40-46, 2002.
2. Alivisatos A.P., “Semiconductor clusters, nanocrystals, and quantum dots”, Science, 271, 933-937, 1996.
3. Han M., Gao X., Su J.Z. and Nie S., “Quantum dot-tagged microbeads for multiplexed optical coding of biomolecules”, Nat. Biotechnol., 19, 631-635, 2001.
4. Niemeyer C.M., “Nanoparticles, proteins, and nucleic acids: Biotechnology meets materials science”, Angrew. Chem. Int. Ed. Engl., 40, 4128-4158, 2001.
5. Leatherdale C.A., Woo W.K., Mikulec F.V. and Bawendi M.G., “On the absorption cross section of CdSe nanocrystal quantum dots”, J. Phys. Chem. B, 106, 7619-7622, 2002.
6. Bruchez M., Moronne M., Gin P., Weiss S. and Alivisatos A.P., “Semiconductor nanocrystals as fluorescent biological labels”, Science, 281, 2013-2015, 1998.
7. Mattoussi H., Mauro J.M., Goldman E.R., Anderson G.P., Sundar V.C., Mikulec F.V. and Bawendi M.G., “Self-assembly of CdSe-ZnS quantum dot bioconjugates using an engineered recombinant protein”, J. Am. Chem. Soc., 122, 12142-12150, 2000.
8. Dubertret B., Skourides P., Norris D.J., Noireaux V., Brivanlou A.H. and Libchaber A., “In vivo imaging of QDs encapsulated in phospholipid micelles”, Science, 298, 1759-1762, 2002.
9. Jaiswal J.K., Mattoussi H., Mauro J.M. and Simon S.M., “Long-term multiple color imaging of live cells using quantum dot bioconjugates”, Nat. Biotechnol., 21, 47-51, 2003.
10. Larson D.R., Zipfel W.R., Williams R.M., Clark S.W., Bruchez M.P., Wise F.W. and Webb W.W., “Water-soluble quantum dots for multiphoton fluorescence imaging in vivo”, Science, 300, 1434-1436, 2003.
11. Ishii, D., Kinbara K., Ishida Y., Ishii N., Okochi M., Yohda M. and Aida T., “Chaperonin-mediated stabilization and ATP-triggered release of semiconductor nanoparticles”, Nature, 423, 628-632, 2003.
12. Medintz I.L., Clapp A.R., Mattoussi H., Goldman E.R., Fisher B. and Mauro J.M., “Self-assembled nanoscale biosensors based on quantum dot FRET donors”, Nat. Mater., 2, 630-639, 2003.
13. Dahan M., Levi S., Luccardini C., Rostaing P., Riveau B. and Triller A., “Diffusion dynamics of glycine receptors revealed by single-quantum dot tracking”, Science, 302, 442-445, 2003.
14. Rosenthal S.J., Tomlinson I., Adkins E.M., Schroeter S., Adams S., Swafford L., McBride J., Wang Y., DeFelice L.J. and Blakely R.D., “Targeting cell surface receptors with ligand-conjugated nanocrystals”, J. Am. Chem. Soc., 124, 4586-4594, 2002.
15. Mahtab R., Harden H.H. and Murphy C.J., “Temperature- and salt-dependent binding of long DNA to protein-sized quantum dots: thermodynamics of “inorganic protein”-DNA interactions”, J. Am. Chem. Soc., 122, 14-17, 2000.
16. Sun B., Xie W., Yi G., Chen D., Zhou Y. and Cheng J., “Microminiaturized immunoassays using quantum dots as fluorescent label by laser confocal scanning fluorescence detection”, J. Immunological Methods, 249, 85-89, 2001.
17. Pathak S., Choi S.-K., Arnheim N. and Thompson M.E., “Hydroxylated quantum dots as luminescent probes for in situ hybridization”, J. Am. Chem. Soc., 123, 4103-4104, 2001.
18. Klarreich E., “Biologists join the dots”, Nature, 413, 450-452, 2001.
19. Mitchell P., “Turning the spotlight on cellular imaging”, Nat. Biotechnol., 19, 1013-1017, 2001.
20. Jovin T.M., “Quantum dots finally come of age”, Nat. Biotechnol., 21, 32-33, 2003.
21. Seydel C., “Quantum dots get wet”, Science, 3000, 80-81, 2003.
22. Taton T.A., “Bio-nanotechnology: two way traffic”, Nat. Mater., 2, 73-74, 2003.
23. Bentolila L.A. and Weiss S., “Biological quantum dots go live”, Phys. World, 16, 23-24, 2003.
24. Uren R.F., “Cancer surgery joins the dots”, Nat. Biotechnol., 22, 38-39, 2004.
25. Michalet X., Pinaud F. , Lacoste T.D., Dahan M., Bruchez M.P., Alivisatos A.P. and Weiss S., “Properties of fluorescent semiconductor nanocrystals and their application to biological labelling”, Single Mol., 2, 261-276, 2001.
26. Sutherland A.J., “Quantum dots as luminescent probes in biological systems”, Curr. Opin. Solid State Mater. Sci., 6, 365-370, 2003.
27. Watson A., Wu X. and Bruchez M., “Lighting up cells with quantum dots”, Biotechniques, 34, 296-303, 2003.
28. Parak W.J., Gerion D., Pellegrino T., Zanchet D., Micheel C., Williams S.C., Boudreau R., Le Gros M.A., Larabell C.A. and Alivisatos A.P., “Biological applications of colloidal nanocrystals”, Nanotechnology, 14, R15-27, 2003.
29. Bagwe R.P., Zhao X. and Tan W., “Bioconjugated luminescent nanoparticles for biological applications”, J. Dispersion. Sci. Technol., 24, 453-464, 2003.
30. Dubertret B., “In vivo imaging using quantum dots”, J. Med. Sci., 19, 532-534, 2003.
31. Alivisatos A.P., “The use of nanocrystals in biological detection”, Nat. Biotechnol., 22, 47-51, 2004.
32. Pellegrino T., Kudera S., Liedl T., Javier A.M., Manna L. and Parak W.J., “On the development of colloidal nanoparticles towards multifunctional structures and their possible use for biological applications”, Small, 1, 48-63, 2005.
33. Michalet X., Pinaud F.F., Bentolila L.A., Tsay J.M., Doose S., Li J.J., Sundaresan G., Wu A.M., Gambhir S.S. and Weiss S., “Quantum dots for live cells, in vivo imaging, and diagnostics”, Science, 307, 538-544, 2005.
34. Kim S., Lim Y.T., Soltesz E.G., De Grand A.M., Lee J., Nakayama A., Parker J.A., Mihaljevic T., Laurence R.G., Dor D.M., Cohn L.H., Bawendi M.G. and Frangioni J.V., “Near-infrared fluorescent type II quantum dots for sentinel lymph node mapping”, Nat. Biotechnol., 22, 93-97, 2004.
35. Gao X., Cui Y., Levenson R.M., Chung L.W.K. and Nie S., “In vivo cancer targeting and imaging with semiconductor quantum dots”, Nat. Biotechnol., 22, 969-976, 2004.
36. Jaiswal J.K. and Simon S.M., “Potentials and pitfalls of fluorescent quantum dots for biological imaging”, Trends Cell Biol., 14, 497-504, 2004.
37. Medintz I.L., Uyeda H.T., Goldman E.R. and Mattoussi H., “Quantum dot bioconjugates for imaging, labelling and sensing”, Nat. Mater., 4, 435-446, 2005.
38. Wu X., Liu H., Haley K.N., Treadway J.A., Larson J.P., Ge N., Peale F. and Bruchez M.P., “Immunofluorescent labeling of cancer marker Her2 and other cellular targets with semiconductor quantum dots”, Nature Biotechnology, 21, 41-46, 2003.
39. Mattheakis L.C., Dias J.M., Choi Y.-J., Gong J., Bruchez M., Liu J. and Wang E., “Optical coding of mammialian cells using semiconductor quantum dots”, Anal. Biochem., 327, 200-208, 2004.
40. Rosenthal S.J., “Bar-coding biomolecules with fluorescent nanocrystals”, Nat. Biotechnol., 19, 621-622, 2001.
41. Talapin D.V., Rogach A.L., Kornowski A., Haase M. and Weller H., “Highly luminescent monodisperse CdSe and CdSe/ZnS nanocrystals synthesized in a hexadecylamine-trioctylphosphine oxide-trioctylphosphine mixture”, Nano Lett., 1, 207-211, 2001.
42. Peng Z.A. and Peng X., “Formation of high-quality CdTe, CdSe, and CdS nanocrystals using CdO as precursor”, J. Am. Chem. Soc., 123, 183-184, 2001.
43. Reiss P., Bleuse J. and Pron A., “Highly luminescent CdSe/ZnSe core/shell nanocrystals of low size dispersion”, Nano Lett., 2, 781-784, 2002.
44. Parak W.J., Gerion D., Zanchet D., Woerz A. S., Pellegrino T., Micheel C., Williams S. C., Seitz M., Bruehl R. E., Bryant Z., Bustamante C., Bertozzi C. R. and Alivisatos A. P., “Conjugation of DNA to silanized colloidal semiconductor nanocrystaline quantum dots”, Chem. Mater., 14, 2113-2119, 2002.
45. Wilhelm C., Billotey C., Roger J., Pons J.N., Bacri J.C. and Gazeau F., “Intracellular uptake of anionic superparamagnetic nanoparticles as a function of their surface coating”, Biomaterials, 24, 1001-1011, 2003.
46. Pellegrino T., Manna L. and Kudera S., “Hydrophobic nanocrystals coated with an amphiphilic polymer shell: a general route to water soluble nanocrystals”, Nano Lett., 4, 703-07, 2004.
47. Petruska M.A., Bartko A.P. and Klimov V.I., “An amphiphilic approach to nanocrystal quantum dot-titania nanocomposites”, J. Am. Chem. Soc., 126, 714-715, 2004.
48. Ballou B., Lagerholm B.C., Ernst L.A., Bruchez M.P. and Waggoner A.S., “Noninvasive imaging of quantum dots in mice”, Bioconjug. Chem., 15, 79-86, 2004.
49. Murray C.B., Kagan C.R. and Bawendi M.G., “Synthesis and characterization of monodisperse nanocrystals and close-packed nanocrystal assemblies”, Annu. Rev. Mater. Sci., 30, 545-610, 2000.
50. Qu L. and Peng X., “Control of photoluminescence properties of CdSe nanocrystals in growth”, J. Am. Chem. Soc., 124, 2049-2055, 2002.
51. Kippeny T., Swafford L.A. and Rosenthal S.J., “Semiconductor nanocrystals: a powerful visual aid for introducing the particle in a box”, J. Chem Educ., 79, 1094, 2002.
52. Yu W.W., Qu L., Guo W. and Peng X., “Experimental determination of the extinction coefficient of CdTe, CdSe, and CdS nanocrystals”, Chem. Mater., 15, 2854-2860, 2003.
53. Gao X.H. and Nie S.M., “Molecular profiling of single cells and tissue specimens with quantum dots”, Trends Biotechnol., 21, 371-373, 2003.
54. Jovin T.M., “Quantum dots finally come of age”, Nat. Biotechnol., 21, 32-33, 2003.
55. Lidke D.S., Nagy P., Heintzmann R., Arndt-Jovin D.J., Post J.N., Grecco H.E., Jares-Erijman E.A. and Jovin T.M., “Quantum dot ligands provide new insights into erbB/HER receptor-mediated signal transduction”, Nat. Biotechnol., 22, 198-203, 2004.
56. Derfus A.M., Chan W.C.W. and Bhatia S.N., “Probing the cytotoxicity of semiconductor quantum dots”, Nano Lett., 4, 11-18, 2004.
57. Akerman M.E., Chan W.C.W., Laakkonen P., Bhatia S.N. and Ruoslahti, E., “Nanocrystal targeting in vivo”, PNAS, 99, 12617-21, 2002.
58. Ness J.M., Akhtar R.S., Latham C.B. and Roth K.A., “Combined tyramide signal amplification and quantum dots for sensitive and photostable immunofluorescence detection”, J. Histochem. Cytochem., 51, 981-987, 2003.
59. Peng X., Schlamp M.C., Kadavanich, A.V. and Alivisatos A.P., “Epitaxial growth of highly luminescent CdSe/CdS core/shell nanocrystals with photostability and electronic accessibility”, J. Am. Chem. Soc., 119, 7019-7029, 1997.
60. Murray C.B., Norris D.J. and Bawendi M.G., “Synthesis and characterization of nearly monodisperse CdE (E=S, Se, Te) semiconductor nanocrystallites”, J. Am. Chem. Soc., 115, 8706-8715, 1993.
61. Dabbousi B.O., Rodriguez-Viejo J., Mikulec F.V., Heine J.R., Mattoussi H., Ober R., Jensen K.F. and Bawendi M.G., “(CdSe)ZnS core-shell quantum dots: Synthesis and characterization of a size series of highly luminescent nanocrystallites”, J. Phys. Chem. B, 101, 9463-9475, 1997.
62. Hines M.A. and Guyot-Sionnest P., “Synthesis of strongly luminescing ZnS-capped CdSe nanocrystals”, J. Phys. Chem. B, 100, 468-471, 1996.
63. Chan W.C.W. and Nie S., “Quantum dot bioconjugates for ultrasensitive nonisotopic detection”, Science, 281, 2016-2018, 1998.
64. Mitchell G.P., Mirkin C.A. and Letsinger R.L., “Programmed assembly of DNA functionalized quantum dots”, J. Am. Chem. Soc., 121, 8122-8123, 1999.
65. Nirmal M., Dabbousi B.O., Bawendi M.G., Macklin J.J., Trautman J.K., Harris T.D. and Brus L.E., “Fluorescence intermittency in single cadmium selenide nanocrystals”, Nature, 383, 802-804, 1996.
66. Efros, A.L. and Rosen, M., “Random telegraph signal in the photoluminescence intensity of a single quantum dot”, Phys. Rev. Lett., 78, 1110-1113, 1997.
67. Chen Y. and Rosenzweig Z., “Luminescent CdS quantum dots as selective ion probes”, Anal. Chem., 74, 5132-5138, 2002.
68. Gao X., Cui Y., Levenson R.M., Chung L.W.K. and Nie, S., “In vivo cancer targeting and imaging with semiconductor quantum dots”, Nature Biotechnology, 22, 969-76, 2004.
69. So M.K., Xu C., Loening A.M., Gambhir S.S. and Rao J., “Self-illuminating quantum dot conjugates for in vivo imaging”, Nature Biotechnology, 24, 339-43, 2006.
70. Duncan R., “The dawning era of polymer therapeutics”, Nat. Rev. Drug Discov., 2, 347-360, 2003.
71. Jain R.K., “Transport of molecules, particles, and cells in solid tumors”, Ann. Rev. Biomed. Eng., 1, 241-263, 1999.
72. Jain R.K., “Delivery of molecular medicine to solid tumors: lessons from in vivo imaging of gene expression and function”, J. Control. Release, 74, 7-25, 2001.
73. Cheong W.F., Prahl S.A. and Welch A.J., “A review of the optical properties of biological tissues”, IEEE J. Quantum Electron., 26, 2166-2185, 1990.
74. Ntziachristos V., Bremer C. and Weissleder R., “Fluorescence imaging with near-infrared light: new technological advances that enable in vivo molecular imaging”, Eur. Radiol., 13, 195-208, 2003.
75. Zhang C.Y., Ma H., Nie S.M., Ding Y., Jin L. and Chen D.Y., “Quantum dot-labeled trichosanthin”, Analyst, 125, 1029-1031, 2000.
76. Winter J.O., Liu T.Y., Korgel B.A. and Schmidt C.E., “Recognition molecule directed interfacing between semiconductor quantum dots and nerve cells”, Adv. Mater., 13, 1673-1677, 2001.
77. Kloepfer J.A., Mielke R.E., Wong M.S., Nealson K.H., Stucky G. and Nadeau J.L., “Quantum dots as strain- and metabolism-specific microbiological labels”, Appl. Environ. Microbiol., 69, 4205-4213, 2003.
78. Goldman E.R., Anderson, G.P., Tran P.T., Matttoussi H., Charles P.T. and Mauro J.M., “Conjugation of luminescent quantum dots with antibodies using an engineered adaptor protein to provide new reagents for fluoroimmunoassays”, Anal. Chem., 74, 841-47, 2002.
79. Kapanidis A.N., Ebright Y.W. and Ebright R.H., “Site-specific incorporation of fluorescent probes into protein: hexahistidine-tag-mediated fluorescent labeling with (Ni(2+):nitrilotriacetic Acid (n)-fluorochrome conjugates”, J. Am. Chem. Soc., 123, 12123-25, 2001.
80. Tokumasu F. and Dvorak J., “Development and application of quantum dots for immunocytochemistry of human erythrocytes”, J. Microsc., 211, 256-261, 2003.
81. Gerion D., Chen F., Kannan B., Fu A., Parak W.J., Chen D.J., Majumdar A. and Alivisatos A.P., “Ultra-fast room-temperature single nucleotide polymorphism detection and multi-allele DNA detection using fluorescent nanocrystal probes and microarray”, Anal. Chem., 75, 4766-4772, 2003.
82. Dahan M., Laurence T., Pinaud F., Chemla D. S., Alivisatos A. P., Sauer M. and Weiss S., “Time-gated biological imaging by use of colloidal quantum dots”, Opt. Lett., 26, 825-827, 2001.
83. Goldmann E.R., Clapp A.R., Anderson G.P., Uyeda H.T., Mauro J.M., Medintz I.L. and Mattoussi H., “Multiplexed toxin analysis using four colors of quantum dot fluororeagents”, Anal. Chem., 76, 684-88, 2004.
84. Makrides S.C., Gasbarro C. and Bello J.M., “Bioconjugation of quantum dot luminescent probes for western blot analysis”, Biotechniques, 39, 501-506, 2005.
85. Ward W.W. and Cormier M.J., “Energy transfer via protein-protein interaction in Renilla bioluminescence”, Photochem. Photobiol., 27, 389-396, 1978.
86. Wilson T. and Hastings J.W., “Bioluminescence”, Annu. Rev. Cell Dev. Biol., 14, 197-230, 1998.
87. De A. and Gambhir S.S., “Non-invasive imaging of protein-protein interactions from live cells and living subjects using bioluminescence resonance energy transfer”, FASEB J., 19, 2017-2019, 2005.