由于氟原子半徑小,且具有最強的電負性(4.0),引入氟原子后對C-F鍵極性方向和整個分子的電子云分布均會發(fā)生變化,影響分子的偶極矩、酸堿性等,進而影響整個分子的物理性質(zhì)和化學性質(zhì)。
氟原子或含氟基團的引入通常還會增加分子的脂溶性和疏水性,提高藥物分子的溶解度,促進藥物的傳導和吸收。所以很多含氟藥物或者農(nóng)藥相對具有用量少、毒性低、藥效高等特點,這使得含氟藥物或農(nóng)藥所占比例越來越高。
在各種含氟砌塊中,烯基含氟砌塊是非常重要的生物活性分子結構,具有各種藥理活性(如抗癌、抗菌、抗艾滋病毒、抗糖尿病),還可以作為合成砌塊用于制備不同的含氟官能團。
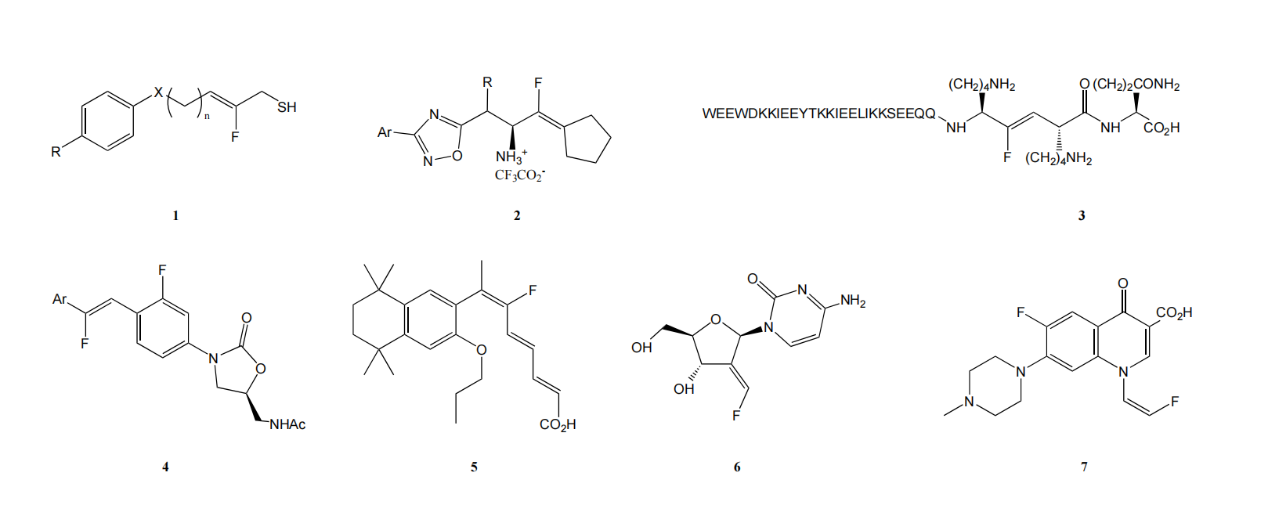
圖1. 具有生物活性的烯基含氟砌塊
1.HDAC抑制劑(histone deacetylase inhibitors)——抗癌
2.DPP-4抑制劑(Dipeptidyl peptidase 4 inhibitors)——抗2型糖尿病
3.HIV融合抑制劑(HIV fusion inhibitor)——抗艾滋病毒藥物
4.蛋白合成抑制劑 (Protein synthesis inhibitors)——抗菌藥物
5.視黃醇X受體調(diào)節(jié)劑(Retinoid X receptor regulator )——抗2型糖尿病
6.核糖核苷酸還原酶抑制劑(Ribonucleotide reductase inhibitor)——抗癌
7.DNA回旋酶抑制劑(DNA gyrase inhibitor)——抗菌藥物
合成方法
1. 烯化反應
2-氟-2-膦酰基乙酸三乙酯(Triethyl 2-fluoro-2-phosphonoacetate)和氟甲基苯基砜(Fluoromethyl phenyl sulfone)是比較經(jīng)典的單氟砌塊。
2-氟-2-膦酰基乙酸三乙酯通常由膦酰基乙酸三乙酯通過親電氟化試劑氟化合成,其可以在堿作用下與醛酮化合物經(jīng)由膦葉立德中間體制得α-氟-α,β-不飽和羧酸酯 。其中,醛羰基反應活性高于酮羰基反應活性,同時還具有更好的順反選擇性。(方案1)
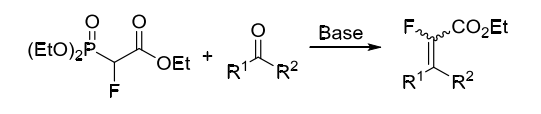
方案1. 2-氟-2-膦酰基乙酸三乙酯作為含氟砌塊
1994年,Patrick課題組報道甘油醛和2-氟-2-膦酰基乙酸三乙酯在丁基鋰作用下E式單一產(chǎn)物[1]。(方案2)
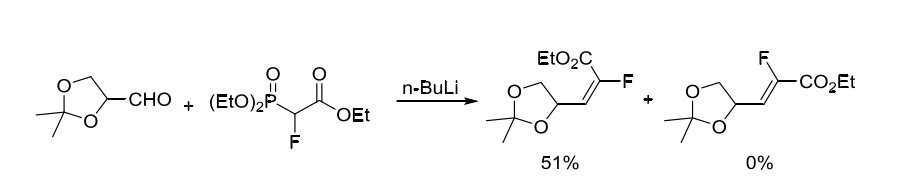
方案2. 2-氟-2-膦酰基乙酸三乙酯作為含氟砌塊
Gernert課題組也在2003年使用2-氟-2-膦酰基乙酸三乙酯與酮羰基化合物反應合成氟化產(chǎn)物,但產(chǎn)物是不具有順反選擇性的[2]。(方案3)
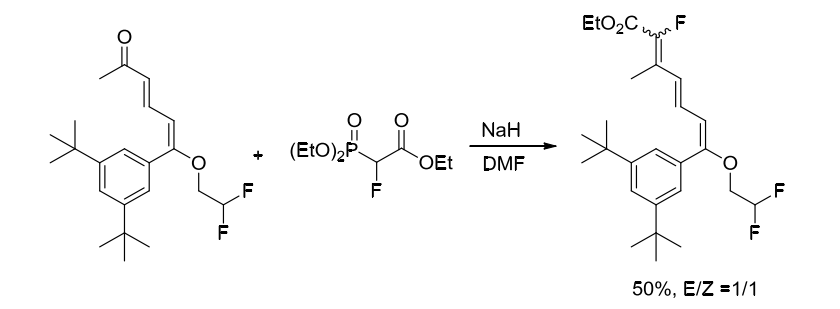
方案3. 使用含氟砌塊2-氟-2-膦酰基乙酸三乙酯合成氟化烯烴
上文提到的氟甲基苯基砜近年來也被作為被經(jīng)常使用的含氟砌塊。在1985年,McCarthy課題組早在1985年研究了其制備方法,反應性質(zhì)以及反應機理。氟甲基苯基砜首先會與丁基鋰反應生成氟甲基苯基砜鋰鹽中間體,然后直接與芳香醛反應得到相應的α-氟-β-羥基砜化合物。該化合物再通過脫去砜基以形成單氟末端烯烴[3-5]。(方案4)
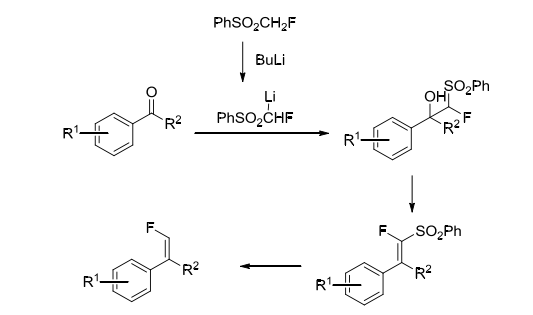
方案4. 氟甲基苯基砜作為含氟砌塊
2.消除反應
消除反應是制備α-取代的α-氟烯烴的常用方法。為了將末端烯烴轉(zhuǎn)化為它們的氟化當量,鹵化反應和消除反應被廣泛使用
[6]。(方案5)。
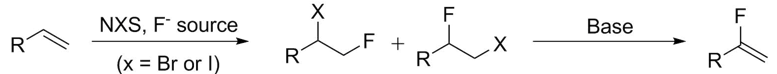
這種消除過程通常被認為是SN2反應的競爭過程,特別是當存在強堿時。它可以發(fā)生在一級、二級和三級底物上。除非使用特殊的非親核胺堿,否則強堿存在下的初級底物通常只會產(chǎn)生取代。
用具有強堿和胺堿的二級和三級底物很容易消除。消除是二級的,取決于底物和堿濃度。堿需要在一步過程中攻擊β-氫。
大多數(shù)E2反應提供取代最多的烯烴作為主要異構體,但可能使用的條件會改變區(qū)域選擇性。形成更多取代的烯烴稱為Saytzeff消除。反應的區(qū)域選擇性受堿的性質(zhì)影響很大。大的叔丁醇堿太大而不能攻擊內(nèi)部CH2基團,從而攻擊CH3基團。甲醇比叔丁醇更小,對CH2基團的攻擊更大,但主要產(chǎn)物仍然是1-烯烴。
幾乎所有的消除反應都產(chǎn)生烯烴混合物,而不是一種清潔的產(chǎn)物。反應由產(chǎn)物的穩(wěn)定性(和過渡態(tài))決定,因此烯烴的穩(wěn)定性差異很小。取代度高的烯烴比取代度低的烯烴更穩(wěn)定,但能量差很小。
此外,當E和Z烯烴異構體可能存在時,主要異構體是E異構體,但Z異構體通常存在一定程度。
3.交叉偶聯(lián)反應
在金屬催化交叉偶聯(lián)領域,Heck反應是烯烴芳基化的一種非常方便的方法。在大多數(shù)情況下,乙烯基的氫原子被有機鹵化物的有機殘基取代。當使用不對稱取代的烯烴時,由于空間位阻決定的高區(qū)域選擇性,導致在較少取代位點發(fā)生烯烴芳基化。反應的關鍵步驟之一是β-氫化物消除。
1991年,Heitz和Knebelkamp試圖從芳基碘化物和偏二氟乙烯合成β,β-二氟苯乙烯。在乙酸鈀催化作用下,如果β-氫化物消除是必要的反應步驟,β,β-二氟苯乙烯應該是唯一的反應產(chǎn)物。而β,β二氟苯乙烯在這些反應中僅作為副產(chǎn)物形成。第一次發(fā)現(xiàn)了在Pd(OAc)2催化條件下使芳基碘化物與1,1-二氟乙烯反應來獲得α-氟乙烯衍生物的一步反應[7]。(方案6)
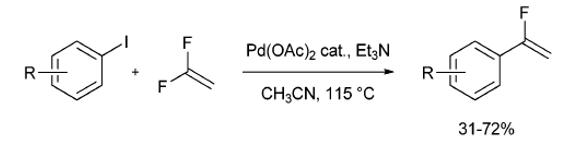
4.親電氟化
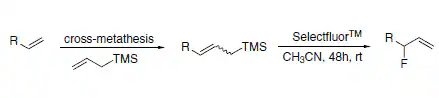
Pacheco和Gouverneur研究了烯丙基甲基硅烷在Selectfluors反應條件下的反應性,以便在不使用氟化構建塊的情況下進行親電氟脫硅反應制備氟二烯怕[8]。(方案7)
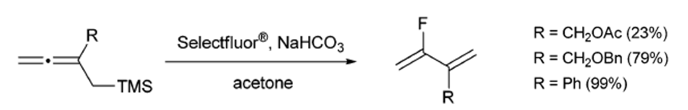
其中,Selectfluor氟化試劑(N-氟-N'-(氯甲基)三乙二胺雙(四氟硼酸鹽)或F-TEDA)是一種用戶友好性的、溫和的、在空氣和水分狀況下穩(wěn)定的、非揮發(fā)性的親電氟化反應劑。Selectfluor氟化試劑能夠在一個步驟內(nèi)將氟引入有機底物,具有非常廣泛的反應范圍[9]。這些反應中,絕大多數(shù)都表現(xiàn)出了優(yōu)異的區(qū)域選擇性。
烯丙基氟化物可以通過交叉復分解反應/親電氟脫硅路線制備(方案8)。這種途徑避免了使用DAST進行親核置換或開環(huán)反應時烯丙基轉(zhuǎn)位產(chǎn)生的副產(chǎn)物的形成[10]。
應用
目前含氟砌塊已經(jīng)在醫(yī)藥、農(nóng)藥、染料、表面活性劑、氟碳材料、航空航天等各種化工領域得到廣泛應用。
其中,烯基含氟砌塊在材料科學和合成有機化學中具有潛在的應用,可以用作氟化合成子進行進一步的功能化。此外,氟化烯基可以作為肽鍵同工酶用于藥物化學,這為尋找新的生物活性化合物開辟了新的機會。
參考文獻
1.Patrick, T. B.; Lanahan, M. V.; Yang, C.; Walker, J. K.; Hutchinson, C. L.; Neal, B. E., J. Org. Chem.1994,59, 1210.
2. Gernert, D. L.; Ajamie, R.; Ardecky, R. A.; Bell, M. G.; Leibowitz, M. D.; Mais, D. A.; Mapes, C. M.; Michellys, P. Y.; Rungta, D.; Reifel-Miller, A.; Tyhonas, J. S.; Yumibe, N.; Grese, T. A., Bioorg. Med.
Chem. Lett.2003,13, 3191.
3. McCarthy, J. R.; Peet, N. P.; LeTourneau, M. E.; Inbasekaran, M., J. Am. Chem. Soc.1985,107, 735.
4. McCarthy, J. R.; Peet, N. P.; LeTourneau, M. E.; Inbasekaran, M., J. Am. Chem. Soc.1985,107, 735.
5. McCarthy, J. R.; Huber, E. W.; Le, T.-B.; Mark Laskovics, F.; Matthews, D. P., Tetrahedron 1996,52, 45.
6. Takeuchi Yoshio,Yamada Asuka,Suzuki Takanori,Koizumi Toru. Synthetic studies towards proline amide isosteres, potentially useful molecules for biological investigations[J]. Tetrahedron,1996,52(1).
7. Walter Heitz,Arno Knebelkamp. Synthesis of fluorostyrenes via palladium‐catalyzed reactions of aromatic halides with fluoroolefins[J]. Macromolecular Rapid Communications,1991,12(2).
8. Furuya Takeru,Ritter Tobias. Fluorination of boronic acids mediated by silver(I) triflate.[J]. Organic letters,2009,11(13).
9. Singh, R. P. , Shreeve, J. M.. 2004. For a review of recent highlights: Acc. Chem. Res..37, 31.
10. Thibaudeau S, Gouverneur V. 2003. Sequential Cross-Metathesis/Electrophilic Fluorodesilylation:? A Novel Entry to Functionalized Allylic Fluorides. Org. Lett.. 5(25):4891-4893.